Жидкое топливо
Жидкое топливо использовалось в туризме и на кухнях довольно давно. Началось всё с
керосинки. Это самый простой вариант нагревательного прибора. Фитили керосинки были
опущены в резервуар с керосином и над ними были расположены вытяжные трубы. Не очень
эффективный метод использвания горючего, но это значительно лучше чем использование
дров или угля. Керосинка выглядит следующим образом.
В дальнейшем было придумано как исключить фитили из процесса огнеобразования и
были созданы плиты по типу керосинки, с асбестовым и хлопчатобумажным фитилём. Асбестовые
фитили отличались большим расходом топлива, в среднем 180-190 грамм в час, но при этом
у них была большая теплоотдача. А вот у керогазов основанных на хлопчатобумажном фитиле
расходовали около 80 грамм в час, но и мощность была ниже. Выглядел керогаз
вот так.
Но технологии не стояли на месте. И в 1892 году Францем Вильгельмом Линдквистом был изобретен
примус. Это изобретение оказалось очень успешным как для туристического мира так и для быта
в принципе. Так же сейчас существует масса бензиновых горелок для приготовления еды. Туристичексая
горелка компактная, заправляется керосином или бензинагудВот один из примеров горелки на
жидком топливе.

Каков всё-таки плюс этого горючего? Жидкое топливо проще найти в разных малоцивилизованных
местах. Например в деревнях или на трассе найти жидкое топливо значительно проще чем
любой другой вид топлива производимый с применением технических средств. Проще только спирт,
но не любой продаваемый спирт в действительности горит так как надо.
Бензин в среднем выделяет порядка 10572 ккал на килограмм. Это меньше чем теплотворная
способность пропан-бутановой смеси или каждого из них в отдельности. Но у бензина есть серия
больших плюсов.
Во-первых, жидкое горючее проще перевозить, так как он помещается в разные типы тары под ГСМ.
Во-вторых, дозировать жидкое топливо значительно проще чем газовую смесь, так например, если
один турист может поделиться с другим частью своего запаса топлива из баллона, то имея
один баллон газа на двоих он может испльзоваться только одним туристом.
В-третьих, и это поверьте самое главное, бензин горит при очень низких температурах, по этому
в зимние походы я беру только бензин и горелку для жидкого топлива.
Из минусов хочу заметить только небольшую техническую сложность в подготовке
жидкотопливной горелки. Еще бывают случаи когда топливные ёмкости проливаются
в рюкзаке и почти все синтетические материалы приходят в негодность. Сам, к
счастью, в такую ситуацию не попадал, но слышал про подобные случаи часто.
Метальдегид своими руками
Такой вид сухого топлива, как метальдегид, тоже можно приготовить в домашних условиях. Что вам понадобиться, было описано выше. Так что перейдем прямо к схеме работы.
В первую очередь вам надо разбавить налитый в емкость уксусный альдегид (охарактеризовать его можно так: тусклая летучая вода с характерным неприятным запахом) разбавленной в пропорции один к одному серной кислотой.
Собственно говоря, это и весь процесс. Если вы все сделали правильно, то ацетальдегид будет преобразован в жесткий метальдегид, который пригоден для того, чтобы вырезать из него горючие бруски нужной формы и размера.
Напоминать об осторожности, кажется, будет уже лишним – с серной кислотой надо быть предельно аккуратным
10 полезных фактов о спиртных напитках

О вреде алкоголя, можно сказать, следующее:
- На каждый орган приходится удар, даже на невинный аппендицит.
- В любых алкогольных напитках, имеется в составе этанол (даже те, что характеризуются безалкогольными).
- С течением времени алкоголики теряют восприимчивость к алкоголю, т. е. наблюдается полное отсутствие рвотного рефлекса. Все объясняется тем, что организм потратил все силы и больше не в состоянии противостоять яду.
- Повышенная стойкость к спиртному – начальная стадия алкоголизма.
- При алкоголизме, человек уже не воспринимает алкоголь как раньше, даже после первой рюмки ему может стать плохо, а похмелье будет в разы сильнее.
- Алкоголь старит, женщина 30 лет приравнивается по внешнему виду 55-летней.
- Этанол обладает свойством сворачивать кровь в человеческих сосудах.
- Чтобы умереть, нужно зараз выпить 560 грамм чистого этанола и не «очищать желудок».
- В стопке водки около 40 грамм чистого яда.
- Чтобы впасть в наркозную кому, человеку достаточно выпить 420 гр. чистого токсина.
10 интересных статистических данных
 Статистика гласит:
Статистика гласит:
- Около 4,5 миллиарда человек не пьют, и не курят табак.
- Примерно 41 государство ввело на своей территории «сухой закон».
- Всего 80 государств находятся в трезвом режиме, на алкоголика там смотрят, как на сумасшедшего.
- Около тысячи народов мира – трезвые. Страны, протяженностью от Африки и до Филиппин входят в эту группу, Китай и Индию также можно назвать такими государствами.
- В Китае в год, каждый житель страны выпивает всего рюмку спирта, а вот в России – 24 литра.
- В Норвегии каждая выпитая рюмка учитывается в специальном реестре. Тех, кто пьет каждый день, не принимают на высокооплачиваемые должности.
- Само заболевание не передается детям, а вот склонность к нему – да.
- Если изучить поэтапно весь процесс создания алкогольной продукции, можно заметить, что спирт – это лишь экскременты дрожжевых грибов. Как только они попадают в смесь, они начинают поедать сахар в составе, при этом их моча поступает в раствор, в сумме, бочка на 10% состоит из выделений дрожжей. Данный показатель критичен для самих микроорганизмов, поэтому они начинают гибнуть. Если вино процеживают и выдерживают, то оно носит название марочное, если же нет – ординарное.
- Сейчас магазины продают лишь подделку настоящего шампанского, которое готовится удивительным образом. Дрожжи, помещаемые в раствор, живут там несколько лет. Потом их ослепляют прожекторами, от чего они пугаются, умирают и выпускают газ. Именно благодаря «пузырькам» шампанское так и популярно. Суррогат готовится с использованием углекислоты и сухого вина.
- В год, около миллиона людей погибают от алкогольной зависимости и болезней, первопричиной которых является спиртное.
Газовые смеси
Газовые туристические горелки это один из самых простых и распространенных
методов приготовления пищи в походах. Газовые горелки подкупают своей простотой.
Помимо простоты использования, газ имеет более высокую теплотворную способность
чем бензин. Например, бутан 11783 ккал/кг, пропан 11961 ккал/кг.
Но при этом не забываем, что газовые смеси проигрывают жидкому топливу в объёме.
При сгорании топлива газ расходуется быстрее чем бензин. Одному литру бензина,
соответствует 1.13 литра бутана или 1.27 литра пропана. В туристических баллонах
в подавляющем большинстве используется бутан. А в смесях пропан используется только как
присадка.
Выходит, что большая теплотворная способность сказывается не столько на экономии
горючего, сколько на скорости приготовления.
Теперь же затронем минусы газовых горелок. Основная проблема в газовых картриджах.
Пустой газовый картридж имеет определённый вес и является одноразовым. Получается, что
после использования газового баллона его нужно всё-равно нести до мусорки. Из-за
того, что существует множество типов соединений
и типов газовых гертриджей (баллонов) может возникнуть ситуация, что нет нужных
газовых картриджей. Например, самый распространённый и практически всегда имеющийся в
продаже это картридж с цанговым разьёмом, следующий с резьбовым соединением
и далее идут прокольные.
И ещё один минус о котором хочу предупрелить. Газовые горелки очень плохо себя ведут
на морозе. Даже если используется зимняя газовая смесь с большим количеством пропана и
изобутана, всё-равно они очень плохо горят и баллоны приходится нагревать.

В летний период туристических путешествий всё-же предпочтительнее использовать
газовые баллоны. Особенно если в группе есть люди слабо разбирающиеся в технике.
Преимущества и недостатки
Продукт прост в использовании, легко воспламеняется, имеет небольшой объем в отличие от других видов топлива. Компактен и ценится любителями туристических походов. Занимает мало места в рюкзаке, легок в переноске.
При небольшом объеме это довольно мощный источник тепловой энергии. Сухое горючее способно разогреть пищу и вскипяти воду. Может использоваться как розжиг для костра. Не утрачивает свойства даже в отсыревшем виде.
Сухое горючее незаменимый помощник в туристическом походе
К числу недостатков можно отнести стоимость сухого топлива и невозможность регулирования силы пламени. Количество выделяемого тепла постоянно одинаково. Сварить суп или кашу у таблетки не хватит мощности. Кроме того, огонь хлипкий, чувствительный. Угасает при незначительных порывах ветра. Поэтому использование горючего требует сооружения ветровых барьеров.
Сухое топливо, изготовленное на основе уротропина при сгорании, выделяет едкие вещества: формальдегид, цианид водорода и аммиак.
Виды этанола, используемые в пищевом производстве
Спирт, получаемый после очистки в специальной установке, содержит 95,6% этанола. В зависимости от присутствия в нем сторонних примесей, выделяют несколько категорий вещества (приведены в порядке от более качественного к менее качественному):
-
Альфа
Делают из пшеницы и ржи, используют для производства элитных водок.
-
Люкс
Изготавливают из зерна и картофеля (последнего – не более 35%), подвергают тщательной очистке, применяют для получения водок премиум-категории.
-
Экстра и Базис
Делают из зерна и картофеля, используют для спиртного средней ценовой категории.
-
Высшей очистки
Получают из смеси картофеля, зерна, свеклы и черной патоки (в разных пропорциях), минимально очищают, применяют в производстве настоек, ликеров, водок эконом-класса.
-
1 сорт
В алкогольной промышленности не используют.
Сухое горючее
Сухое горючее это специальные таблетки из, так называемого, сухого спирта.
В подавляющем большинстве таблетки сухого горючего состоят из уротропина. По
теплотворной способности близок к спирту 7500 ккал/кг. Соответственно при
использовании одной или двух таблеток придётся запастись терпением и ждать когда
же закипит вода.
Из плюсов хочу отметить простоту использования сухого горючего, его неприхотливость
и полный расход при использовании в качестве горючего.
Минусы же очевидны. Если идти в небольшой поход выходного дня, то сухое горючее
будет очень удобным средством для разогрева продуктов и кипячения чая. Хочу заметить,
что многие ставят в плюс отсутствие каких-либо устройств для горения, например,
горелок. В этом я совсем не соглашусь, даже для кипячения воды необходима подставка
или таганок, в продаже имеется масса горелок, так же модно изготовить подставку
самостоятельно, но с еёё необходимостью люди сталкиваются лишь выйдя из дома. И я
не перестаю удивляться, люди думают, что посуда будет висеть в воздухе?
Следующая проблема сухого горючего в том, что пламя легко сбивается ветром и
необходимо городить ветрозащиту. Так же у большинства таблеток сухого горючего
неприятный запах уротропина и если брикет с таблетками хранится в закрытом котелке,
то содержимое котелка приобретает это неприятный запах.
Кстати, вот и пример подставки под сухое горючее продаваемое в фирме Сплав.
На текущий момент стоит 330 рублей за 8 таблеток и подставку.
Общий вес 395 грамм. Подставка изготовлена из алюминия.
Сухое горючее отлично подходит для разогрева продуктов. Оно используется в
виде набора из четырёх таблеток и импровизированного таганка который необходимо
согнуть из жестяной пластинки по перфорации. Для такого использования
сухое горючее просто идеально.
Где можно использовать спиртовку?
Спиртовка выручит там, где нет дров. Это может быть, степь, пустыня, горы, пещеры и т. д. Один из вариантов — зимняя рыбалка. В рыболовной палатке на спиртовке вполне можно будет подкрепиться горяченьким.
Ещё один важный момент — это простота конструкции и возможность изготовить топливо самостоятельно. Это особенно будет актуально тем, кто увлекается «выживанием». Если, допустим, случился какой-то глобальный капец, вы сможете сделать и спиртовку и спирт самостоятельно, пользуясь подручными средствами. Газ, бензин или керосин на коленке сам не сделаешь, кроме знаний нужно кое-какое оборудование. А вот соорудить самогонный аппарат и перегнать самогон с высоким градусом, многим будет вполне по силам. Ну а уж спиртовку соорудить можно за 10 минут из пивной банки.
Так же важен и сам запас спирта в походной аптечке. 100 мл. медицинского спирта может лежать в рюкзаке в качестве дезинфицирующего средства, а сама спиртовка из-за малых размеров и веса ни как вас не обременит. Вы можете использовать газ или разводить костёр, но в какой-нибудь критической ситуации, например, когда газ кончился, дров нет или они все насквозь сырые вы всегда сможете вскипятить себе воду, воспользовавшись этим неприкосновенным запасом.
Спиртовку рационально будет использовать для одного, максимум двух человек. Для большей группы нужно либо использовать другие способы приготовления пищи, либо брать каждому по спиртовке, что, на мой взгляд, не имеет особого смысла.
Подведём краткие итоги всего этого рассуждения.
Плюсы использования спиртовки:
- Не сложно сделать своими руками;
- Простая конструкция, не чему ломаться;
- Очень малый вес и компактность;
- Не коптит посуду;
- Не демаскирует запахом и дымом, как костёр;
- Можно использовать в помещении;
- Запас спирта можно использовать не только как топливо;
Минусы спиртовок:
- Нельзя полноценно готовить;
- Спирт дороже газа;
- Для группы не подходит;
- Из-за размеров время горения ограничено;
В заключение, хочу сказать, что всякой вещи своё место и время. И если, та же спиртовка вам кажется бесполезной игрушкой, вспомните, что для кого-то это может оказаться единственной и наиболее подходящей вещью в конкретной ситуации в данный момент.
- < Назад
- Вперёд >
Горючее «мыло»
Следующий вид сухого горючего, которое можно приготовить, – сольват ацетата кальция. Ничего сложного в этом рецепте нет – он самый простой из всех приведенных в статье. Вам потребуется всего лишь добыть немного этилового спирта – для рецепта хватит и двухсот грамм, а точнее, ста семидесяти, и налить его в металлическую емкость. После чего туда добавляется десять миллилитров ацетата кальция (приобрести его можно в виде концентрированного водного раствора, и здесь указано нужное количество именно для этого вещества). После этого жидкость моментально затвердеет, превратившись в полупрозрачное белесое мыло.

Вот, собственно, и все. Вам остается только вырезать из него кубики, таблетки или горючие бруски любой другой формы.
Что такое спиртовка?
Начнём, пожалуй с того, что представляют из себя спиртовки.
 На сегодняшний день кроме лабораторной спиртовки придумано огромное количество всевозможных конструкций, основанных на горении спирта. Нас в данном случае интересуют именно спиртовки которые можно использовать в походной кухне. Чаще всего это небольшая алюминиевая или медная ёмкость с отверстиями по кругу в верхней части, образующими конфорку. Фитиля, как у лабораторной спиртовки в подобных конструкциях нет, их работа основана на горении паров спирта.
На сегодняшний день кроме лабораторной спиртовки придумано огромное количество всевозможных конструкций, основанных на горении спирта. Нас в данном случае интересуют именно спиртовки которые можно использовать в походной кухне. Чаще всего это небольшая алюминиевая или медная ёмкость с отверстиями по кругу в верхней части, образующими конфорку. Фитиля, как у лабораторной спиртовки в подобных конструкциях нет, их работа основана на горении паров спирта.
Подобную спиртовку легко сделать самостоятельно, как я уже писал в предыдущей статье.
А можно не ломать голову и не мозолить руки и уже готовую фирменную вещь за вполне приемлемые деньги.
Первое возражение противников спиртовок: «Спирт жечь расточительно и вообще это кощунство. За поллитру, да я тебя…!»
Если вы считаете, что спирт нужно принимать исключительно внутрь, получая от этого блаженство и просветление, то лучше вообще не читайте дальше, не расшатывайте свою нервную систему.
На самом деле жечь спирт не более расточительно, чем пользоваться сухим горючим, достаточно просто сравнить стоимость. Для кипячения кружки воды нужно грамм 20-30 спирта. Разве это много?
Кроме того, стоит отметить, что кроме спирта можно использовать некоторые жидкости для розжига, которые обойдутся дешевле спирта. Главное, чтобы эта жидкость была достаточно чистая, без запаха, и не оставляла после сгорания маслянистый осадок на стенках спиртовки. Найти подходящую жидкость, к сожалению, можно только опытным путём, покупая разные и тестируя.
«На спиртовке неудобно готовить»
 Да, действительно это так. В отличие от газа или костра, большинство спиртовок горит равномерно и прибавить или убавить огонь нельзя. Но, всё-таки, при определённой сноровке поесть приготовить вполне можно. Другой вопрос — зачем это делать на спиртовке, если она вовсе не предназначена для полноценного приготовления пищи? Если нужно готовить серьёзный обед воспользуйтесь газом или разожгите костёр и не придумывайте себе сложностей.
Да, действительно это так. В отличие от газа или костра, большинство спиртовок горит равномерно и прибавить или убавить огонь нельзя. Но, всё-таки, при определённой сноровке поесть приготовить вполне можно. Другой вопрос — зачем это делать на спиртовке, если она вовсе не предназначена для полноценного приготовления пищи? Если нужно готовить серьёзный обед воспользуйтесь газом или разожгите костёр и не придумывайте себе сложностей.
Опасность для здоровья
В июне 2015 года Роспотребнадзор заявил о потенциальной опасности употребления «сухого алкоголя» для здоровья человека. Наибольший риск заключается в том, что потребитель может развести в стакане воды не один, а несколько пакетиков — в этом случае употребление напитка может привести к алкогольной интоксикации и ожогу слизистых оболочек. Также высок риск при употреблении порошка в сухом виде, через вдыхание.
1 декабря 2015 года было опубликовано распоряжение премьер-министра Дмитрия Медведева «Об утверждении плана мероприятий по стабилизации ситуации и развитию конкуренции на алкогольном рынке». В числе предложенных мер в плане был заявлен запрет продажи «сухого алкоголя» на территории РФ и Евразийского экономического союза (ЕАЭС). 10 декабря 2015 года Московская городская дума внесла в Госдуму законопроект «О внесении изменений в Федеральный закон «О государственном регулировании производства и оборота этилового спирта, алкогольной и спиртосодержащей продукции и об ограничении потребления (распития) алкогольной продукции» (в части установления запрета на производство и оборот спиртосодержащей продукции в сухом виде)».
В сентябре 2016 года правительство РФ положительно оценило законопроект, однако попросило его доработать. В частности, прописать ответственность за производство и оборот «сухого алкоголя». В результате 5 сентября 2017 года самим правительством в Госдуму были внесены два законопроекта: поправки в закон «О государственном регулировании производства и оборота этилового спирта, алкогольной и спиртосодержащей продукции и об ограничении потребления (распития) алкогольной продукции» «в части установления запрета на производство и (или) оборот порошкообразной спиртосодержащей продукции «, а также поправки в Кодекс РФ об административных правонарушениях.
В ноябре 2017 года оба законопроекта прошли первое чтение, однако затем их рассмотрение замедлилось. В законопроект о регулировании было внесено положение, согласно которому порошковым алкоголем можно было считать сухое вещество, предназначенное для получения в жидком виде продукции, содержащей в своем составе этиловый спирт более 0,5% от объема. К его рассмотрению вернулись только в конце 2018 года. 19 декабря он был принят в окончательном, третьем чтении, 21 декабря — одобрен Советом Федерации. 28 декабря закон подписал президент РФ Владимир Путин.
Поправки в КоАП до сих пор не приняты во втором чтении. В первоначальной редакции они предусматривали за производство и оборот «сухого алкоголя» наложение штрафа на граждан и должностных лиц в размере от 20 тыс. до 50 тыс. рублей, на юридических лиц — от 200 тыс. до 500 тыс. рублей. Одновременно предполагалась конфискация «предмета административного правонарушения». Претензии к законопроекту возникли у правового управления Госдумы: в своем заключении они рекомендовали принять его в первом чтении, но ко второму внести уточнения о подведомственности подобных правонарушений. Таким образом, за нарушение запрета на оборот «сухого алкоголя» санкций с 8 января 2019 года не будет.
Этиловый спирт: вред и польза

Этанол, именно так мы зачастую называем этиловый спирт в обиходе, славится своими полезными свойствами. На его основе, конечно же, изготавливают алкогольную продукцию, употребление которой в чрезмерном количестве негативно сказывается на человеческом здоровье. А вот небольшая дозировка этилового спирта или его наружное применение принесут человеческому здоровью неслыханную пользу.
В нашей стране этиловый спирт в чистом виде стали производить около четырех сотен лет назад. А вот в других странах этанол появился гораздо раньше. Сегодня его применение вышло далеко за пределы фармацевтической отрасли. Какую же пользу таит в себе этанол?
Полезные свойства спирта:
- антисептическое воздействие;
- растворение лакокрасочных материалов;
- согревающее воздействие.
На основе этанола часто делают различные компрессы. Народные врачеватели изготавливают настои, которые применяют для лечения всевозможных недугов. Славится этиловый спирт своими согревающими свойствами. Вспомните, многие из нас делали водочные компрессы.
Целебные свойства:
- профилактика желчнокаменной болезни;
- укрепление сердечно-сосудистой системы;
- уничтожение грибковых микроорганизмов, бактерий и вирусов;
- лечение интоксикации метанолом;
- профилактика ишемического заболевания;
- улучшение кровяной свертываемости;
- повышение чувствительности к инсулину;
- профилактика образования тромбов;
- устранение болевых ощущений в мышечной и суставной тканях.
На этом полезные свойства этанола не заканчиваются. Его принимают не только внутрь, но и используют для приготовления настоев и средств для растирания суставов. В альтернативной медицине существует множество различных рецептов приготовления таких лекарств.
Не у каждого человека, к сожалению, есть чувство меры. Если перейти тонкую грань пользы этанола, то человеческий организм будет подвержен серьезным заболеваниям. Речь идет не только об алкогольной интоксикации или алкоголизме.
Под удар попадает сердечно-сосудистая система, пищеварительный тракт. У людей, злоупотребляющих этиловым спиртом, чаще всего возникает цирроз печени. Категорически противопоказано применять этанол в любых проявлениях в период вынашивания плода и лактации.
Для чего же спиртовка в походе?
Основное предназначение спиртовок, на мой взгляд, это кипячение воды. Кипяток позволяет заварить чай, сварить кофе, запарить бичпакеты, заварить каши не требующие варки, заварить супы быстрого приготовления и т. п. Кроме того на спиртовке можно разогреть любые консервы, например из армейского сухпайка. Как видите, всего вышеперечисленного уже вполне достаточно чтобы перекусить в несложном походе, в ПВД или на простой прогулке за город. И с таким питанием можно нормально проходить даже несколько дней. Думаю, это уже оправдывает существование походных спиртовок.
Кроме того, даже в городском парке можно в выходной выйти и попить чай или кофе, сварив его хоть прямо на лавочке.
Одним из основных достоинств спиртовок является малый вес. Моя маленькая спиртовка из аэрозольного баллончика весит чуть больше 10 грамм. Бутылочка спирта к ней 100 грамм. Металлическая кружка и некоторое количество воды у вас будут при любом снаряжении, что с газом, что при костре. При этом, нести газовый баллон, который один уже весит гораздо больше, чтобы вскипятить одну две кружки воды не очень рационально, хотя и удобно.
Ещё одно достоинство спиртовки — она не коптит и посуда остаётся чистой. Запах при сгорании спирта, конечно присутствует, но далеко не такой сильный, как от сухого горючего.
Поэтому спиртовку можно использовать так же, как и газ, в помещении. Надо только обеспечить хоть какую-то вентиляцию. Без притока свежего воздуха в помещении вообще ни какой огонь жечь нельзя — выгорает кислород и есть риск задохнуться.
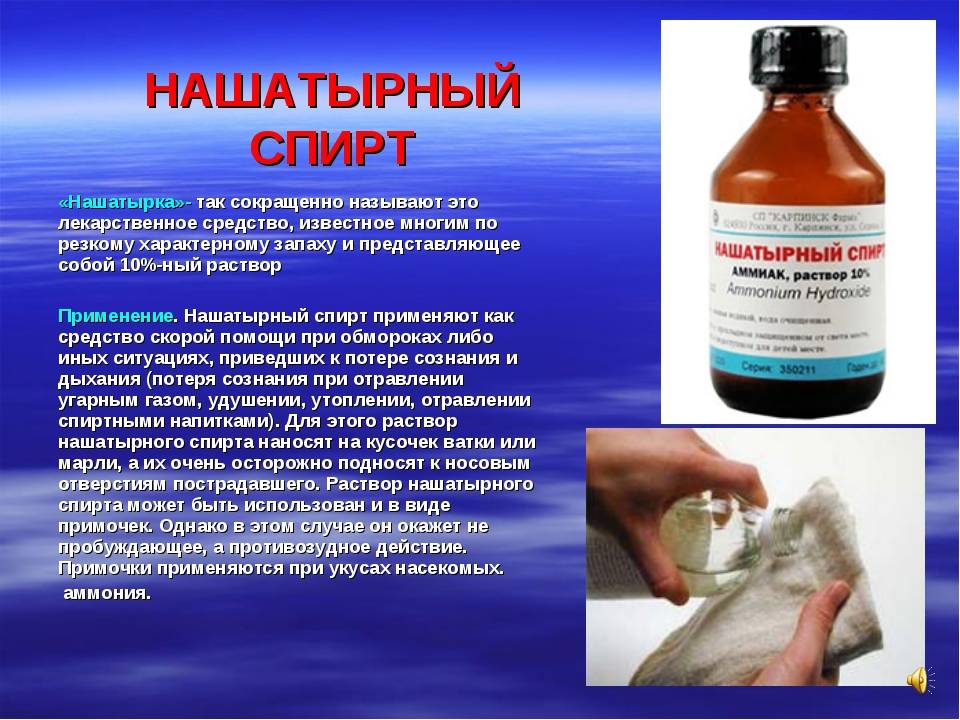
Что нужно знать об аммиаке?

В медицинской практике врачи используют еще один вид спирта. Вы догадались, что это нашатырный спирт. Вред для человека известен, к сожалению, не всем людям. Как правило, нашатырь используют для приведения человека в чувство после обморочного состояния. Достаточно несколько капелек нанести на ватный тампон и вдохнуть. Таким же веществом врачи-хирурги обрабатывают руки непосредственно перед проведением операции.
Полезные свойства:
- ускорение регенерации поврежденных тканей;
- расширение кровеносных сосудов;
- устранение спазмов и напряжения мышечных тканей;
- возбуждающее и антисептическое воздействие;
- ускорение отхождения мокроты;
- повышение уровня артериального давления.
Как правило, нашатырный спирт применяют наружно. Если человек находится в обморочном состоянии, ему необходимо вдохнуть пары раствора аммиака. В этом случае спирт оказывает раздражающее воздействие, стимулирует работу кровеносной системы, повышает артериальное давление. Еще использование нашатыря может спровоцировать рвотный рефлекс.

Используют нашатырный спирт в качестве бактерицидного средства. С его помощью можно избавиться от грибковых микроорганизмов и инфекционных возбудителей. Не только в альтернативной и традиционной медицине используется это химическое вещество. Широкое применение нашатырь нашел в быту и косметологической сфере.
При использовании нашатырного спирта следует соблюдать меры предосторожности, в противном случае такое лекарственное средство обратится в яд и причинит непоправимый вред человеческому организму. При попадании внутрь нашатыря в чистом виде следует спровоцировать рвоту и обратиться незамедлительно за квалифицированной врачебной помощью
- Вред железа для организма человека и его польза
- Вред жевательной резинки для человека
На сегодняшний день существует множество разновидностей спиртов, которые используются в различных сферах нашей жизни. Огромной популярностью пользуется этиловый спирт, составляющий основу алкогольной продукции, лекарственных препаратов, косметики. Даже в пищевой промышленности используется этанол в качестве консерванта. Вот только нужно помнить, что спирт может и причинить непоправимый вред. Так, метанол – это чистейший яд, употребление которого приводит к летальному исходу. Будьте здоровы!